
宿主残留DNA检测试产品
上新啦,快来申请试用装
重组蛋白、抗体、疫苗等基因治疗生物制药产品,在其生产过程中通常需要以宿主细胞为载体,比如CHO、E.coli以及Vero细胞等。由于宿主细胞裂解释放出的DNA具有潜在的致瘤、致突变以及免疫原性等风险,因此世界卫生组织(WHO)、美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)及我国国家药品监督管理局(NMPA)等监管机构对生物制品成品的宿主DNA残留量都有严格的限制,其在生产过程中的清除情况是监管的重要内容。
宿主残留DNA标准
2022年5月国家药品监督管理局药审中心发布了《体内基因治疗产品药学研究与评价技术指导原则(试行)》,首次将风险性DNA残留片段的大小控制在200bp以下进行明文规定,“生产若使用了肿瘤细胞系(如 Hela 细胞)、 致瘤细胞系,或携带有致瘤基因、病毒来源序列的细胞(如 HEK 293T 细胞), 在确保无完整活细胞残留的同时,需对 DNA 的残留量和残留片段大小进行控制,合理拟定标准限度。如有可能,建议尽量将残留 DNA 控制在 10ng/剂以内,DNA 残留片段的大小控制在 200bp 以下”。

《中华人民共和国药典》2020年版第三部,以细胞基质生产的生物制剂DNA残留量不能超过100 pg/剂,以细菌或真菌基质生产的疫苗DNA残留量不能超过10 ng/剂。

残留DNA检测方法
《中华人民共和国药典》2020年版第三部通则3407收录了3种宿主残留DNA检测方法:DNA探针杂交法、荧光染色法和qPCR法。其中DNA探针杂交法不稳定且检测时间长,荧光染色法特异性较差,qPCR法因具有高灵敏度、序列特异性和准确性,现已成为各厂家首选检测方法。

鲲鹏生物制药整体解决方案
鲲鹏基因已开发的残留DNA检测系列产品,涵盖CHO、E.coli、Vero及毕赤酵母四种宿主细胞,上市一年多以来受到客户的广泛好评。为满足客户端的需求,扩充产品线,鲲鹏继续开发了NS0、Sf9&AcMNPV、HEK293、质粒、SV40&E1A 一系列宿主细胞残留DNA检测试剂盒,适用于鲲鹏基因的Archimed X 系列定量PCR仪以及7500、StepOne Plus和CFX96等众多机型。同时配套开发了宿主细胞残留 DNA 提取试剂盒,及自动化核酸提取仪器。鲲鹏基因生物制药残留检测解决方案,包含样品前处理,定量PCR仪以及检测试剂盒整条产品线,助您轻松完成残留检测!
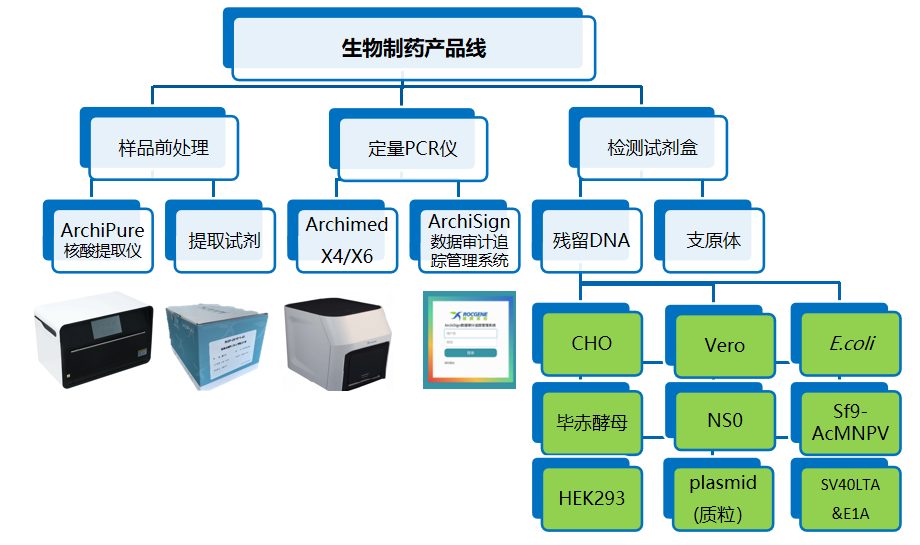
产品特点
1. 准确:试剂盒标准品溯源至国家标准品,检测值CV<5%
2. 灵敏:可稳定检测fg级宿主DNA
3. 快速:60分钟即可完成检测
4.
防污染:dUTP+UNG酶体系,防止气溶胶污染
5. 方便:全预混体系,无需体系配制,分装上样即检
6. 性价比高:性能相当或更优,价格更实惠
性能展示
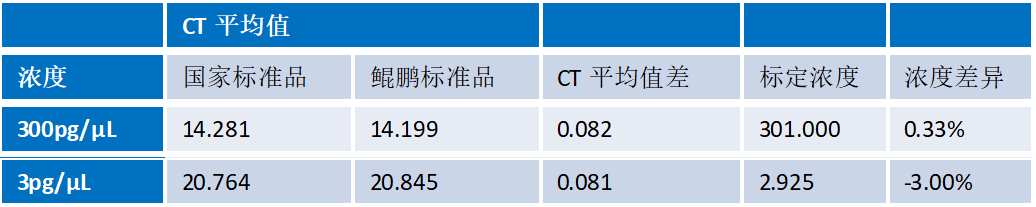
1. 准确性
鲲鹏试剂盒标准品与国家标准品进行平行对比,在3pg/μL和300pg/μL浓度下差异<5%。
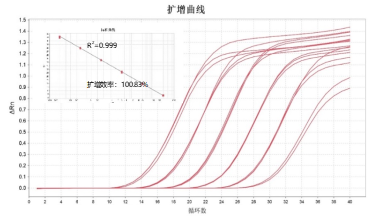
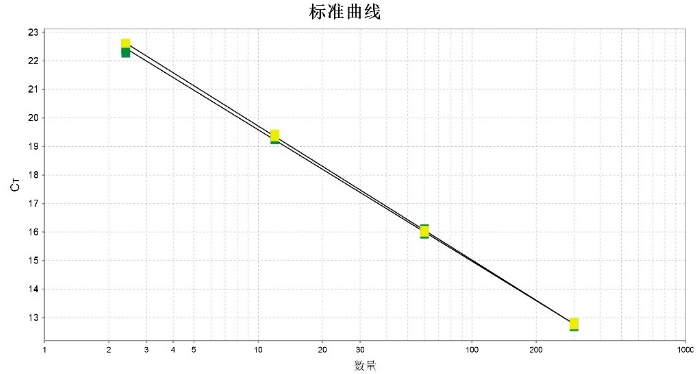
2.特异性
在不同浓度的CHO 细胞来源的DNA中加入100ng人源DNA,显示结果一致,说明试剂盒不被其他来源的DNA所干扰,具有强特异性。
3. 回收率
使用CHO 残留 DNA 检测试剂盒,在加标量为0.25fg-25pg区间下,得到样本回收率在85%-120%之间,优于药典标准(50%-150%)

4. 耐用性
将CHO 细胞衍生的基因组 DNA 通过超声波破碎,结果显示对完整基因组及碎片化DNA具有相同检测结果,证明试剂盒适用不同工艺阶段样品。
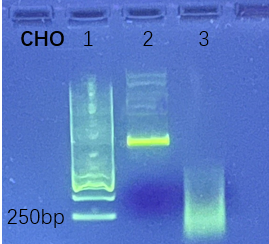
2.未处理;
3.超声30分钟

5.多机型适用
在鲲鹏Archimed X4与ABI 7500仪器上进行平行实验,二者结果一致。
 、
、
鲲鹏X4

7500
欢迎扫码领取试用装


